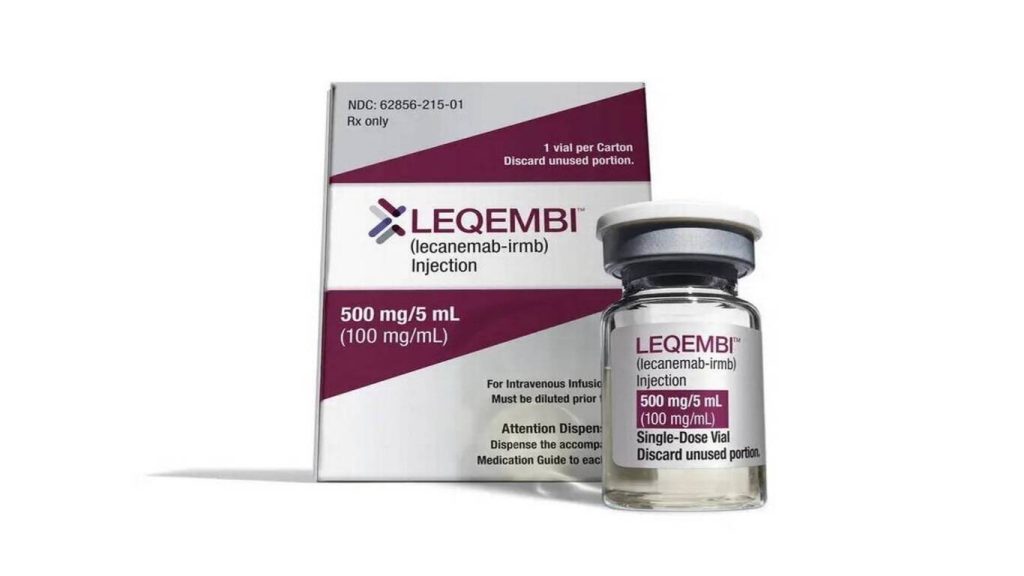
La Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) concedió este jueves la aprobación plena al medicamento contra el alzheimer Leqembi, el primero de eficacia probada para ralentizar el curso de esta enfermedad que destruye la memoria.
Los Centros de Servicios de Medicare y Medicaid (CMS, por sus siglas en inglés) informaron el jueves que ampliarán la cobertura del fármaco, con lo que se extenderá el acceso a hasta un millón de personas con formas tempranas de la enfermedad.
“La decisión de hoy es la primera comprobación de que un fármaco dirigido al proceso subyacente de la enfermedad de Alzhéimer ha mostrado beneficios clínicos en esta devastadora enfermedad”, declaró en el anuncio Teresa Buracchio, directora en funciones de la Oficina de Neurociencia del Centro de Evaluación e Investigación de Medicamentos de la FDA. “Este estudio confirmatorio verificó que es un tratamiento seguro y eficaz para pacientes con enfermedad de Alzheimer”.
Leqembi, de las farmacéuticas Eisai y Biogen, recibió la aprobación acelerada en enero, basándose en pruebas de que elimina las acumulaciones de placa amiloide en el cerebro asociadas a la enfermedad de Alzheimer. Sin embargo, debido a una decisión anterior de cobertura por parte del CMS, que proporciona cobertura de seguro a muchos ancianos con alzheimer a través de Medicare, el fármaco no se ha utilizado de forma generalizada. El tratamiento tiene un costo de US$ 26.500 anuales antes de la cobertura del seguro.
“Tenías este tratamiento al alcance de la mano y, de repente, Medicare te decía: ‘Sí, pero aún no puedes acceder a él'”, explica Joe Montminy, de 59 años, a quien se le diagnosticó alzheimer de aparición más temprana a principios de los 50. “Conseguir esa cobertura del seguro es increíblemente importante”, añade. “Conseguir esa cobertura del seguro es increíblemente significativo (…) porque tener un tratamiento es increíble, pero no puedo permitirme pagar los US$ 26.000 que cuesta”.
“El comienzo de una nueva era”
El fármaco se aprobó solo para personas con formas tempranas de alzheimer, aquellas con deterioro cognitivo leve o demencia leve en las que se ha confirmado la presencia de placas amiloides en el cerebro. El Dr. Lawrence Honig, profesor de Neurología del Centro Médico Irving de la Universidad de Columbia, calcula que ese grupo constituye aproximadamente una sexta parte de los más de 6 millones de estadounidenses diagnosticados actualmente con alzheimer.
Las personas con formas más avanzadas de la enfermedad podrían no beneficiarse del fármaco, dijo, y podrían enfrentarse a mayores riesgos de seguridad.
“No es que sepamos que no es bueno para las personas con enfermedad moderada o grave, es que no lo sabemos”, afirmó Honig, que ha sido consultor de empresas farmacéuticas que trabajan en medicamentos contra el alzheimer.
En un ensayo clínico de 18 meses de duración se demostró que Leqembi desacelera en un 27% el deterioro de la capacidad y la función cognitivas.
“Los tratamientos que tenemos ahora son solo el principio de una nueva era”, afirmó Honig. “Esperamos tener tratamientos que sean más eficaces”.
La Asociación de Alzheimer dijo en un comunicado este jueves que recibe con gusto la aprobación completa de la FDA.
“Este tratamiento, aunque no es una cura, puede dar a las personas en las primeras etapas del alzheimer más tiempo para mantener su independencia y hacer las cosas que aman”, dijo la doctora Joanne Pike, presidenta y CEO del grupo. “Esto proporciona a las personas más meses de reconocimiento de su cónyuge, hijos y nietos. Esto también significa más tiempo para que una persona conduzca con seguridad, se ocupe con precisión y prontitud de las finanzas familiares y participe plenamente en aficiones e intereses”.
Sin embargo, el fármaco también conlleva efectos secundarios y requiere un seguimiento mediante imágenes cerebrales periódicas. Alrededor del 13% de los participantes en el ensayo experimentó inflamación o hemorragias cerebrales, y esos riesgos podrían ser mayores para determinados grupos en función de su genética o si toman medicamentos anticoagulantes. Según la FDA, en la información de prescripción se incluye un recuadro de advertencia para alertar a pacientes y cuidadores de los posibles riesgos asociados a estos efectos secundarios.
Los sistemas sanitarios se han estado preparando para ampliar el uso del medicamento.
“Es complicado y, debido a todas estas complicaciones, hemos intentado ser muy prudentes y tomarnos nuestro tiempo para preparar el sistema”, afirmó el Dr. Georges Naasan, director médico de la División de Neurología Conductual y Neuropsicología del Mount Sinai.
El fármaco se administra en infusión intravenosa una vez cada dos semanas. Los centros de infusión se han estado preparando para una posible oleada de nuevos pacientes.
“En determinadas zonas, preveo que recibiremos probablemente entre un 15% y un 20% más de derivaciones de pacientes para este fármaco”, declaró Sue Rottura, directora de operaciones de Vivo Infusion, que afirma prestar servicios de infusión a unos 50.000 pacientes en EE.UU. “Sabemos que en las clínicas de Florida puede que tengamos que aumentar la capacidad de esas clínicas, y eso puede implicar aumentar el número de días, aumentar las horas [u] ofrecer horas de fin de semana”.
La farmacéutica Eisai dijo que no espera que todas las personas que se estima que padecen alzheimer en fase inicial busquen utilizar el medicamento de inmediato.
“La cifra será mucho más baja, al menos en este momento”, afirmó Ivan Cheung, CEO de Eisai US. “Tal vez dentro de unos años, a medida que se disponga de estas opciones terapéuticas y se reembolsen estas pruebas, esa cifra aumente más, pero no creo que vaya a acudir un millón de personas en los próximos dos años”.
Montminy está a la espera de ver si cumple los requisitos para recibir el fármaco basándose en las imágenes cerebrales, para lo cual Eisai dijo que también espera una decisión de los CMS sobre la cobertura en breve. Si lo es, no dudará en tomarlo por la oportunidad de pasar más tiempo con su mujer y sus dos hijos, que, según dice, están en sus veintes y están al principio de sus carreras.
“A menudo me llaman y me piden consejo sobre el trabajo, y disfruto con esas llamadas, pero me preocupa que algún día no pueda ayudarles”, dice Montminy. “Como a cualquier padre, me encantaría verlos casarse y tener una familia. Básicamente, quiero experimentar muchas de las actividades que la mayoría de la gente da por hecho”.
Cobertura ampliada de Medicare
CMS dijo este año que proporcionaría una cobertura más amplia para Leqembi si el medicamento recibía la aprobación tradicional de la FDA.
“CMS afirma hoy nuestro compromiso de ayudar a las personas con enfermedad de Alzheimer para que accedan a tiempo a tratamientos innovadores que pueden conducir a una mejor atención y mejores resultados”, dijo la administradora Chiquita Brooks-LaSure en un comunicado el jueves. “Con la decisión de la FDA, los CMS cubrirán ampliamente este medicamento mientras continúan recopilando datos que nos ayudarán a comprender cómo funciona el fármaco. Esta es una buena noticia para los millones de personas en este país y sus familias que se ven afectados por esta enfermedad debilitante”.
Los beneficiarios de Medicare probablemente tendrán que hacer frente a ciertos gastos por el Leqembi. Los inscritos en el Medicare tradicional serán responsables del coseguro del 20% de la cantidad aprobada por Medicare una vez que hayan cubierto la franquicia de la Parte B.
La cantidad que tendrán que pagar los afiliados a Medicare Advantage o en planes complementarios variará en función de su póliza.
La cobertura también conlleva algunas condiciones. Medicare cubrirá los medicamentos aprobados cuando un médico y el equipo clínico participan en la recopilación de pruebas acerca de cómo estos medicamentos funcionan en el mundo real, también conocido como un registro, dijo CMS. Esta información ayudará a evaluar la utilidad de los medicamentos para los beneficiarios de Medicare.